Идеальное решение для всех технологических операций в химической и обрабатывающей промышленности. Моделирование кинетики гомогенных химических реакций Моделирование кинетики сложной химической реакции в simulink
ПРОДУКТ: Модуль Химические реакции
Моделируйте тепло- и массообмен с помощью модуля Химические реакции
Реактор с пластинами, в котором химические реакции протекают повсеместно, а реагенты вводятся в двух точках.
Идеальное решение для всех технологических операций в химической и обрабатывающей промышленности
Оптимизация химических реакторов, фильтрационного оборудования, смесителей и других процессов упрощается при использовании модуля Chemical Reaction Engineering (Разработка химических реакций). Он содержит инструменты для моделирования переноса материалов и теплообмена при любой химической кинетике в среде любого типа (в газах, жидкостях, пористых средах, на поверхностях и в твердых фазах) или при их комбинациях. Таким образом, модуль является идеальным решением для всех аспектов химической и обрабатывающей промышленности, и даже в экологической инженерии, где в качестве «технологической установки» или «химического реактора» выступает окружающая среда.
Конвекция и диффузия при произвольной химической кинетике
Модуль Chemical Reaction Engineering (Разработка химических реакций) содержит интуитивно понятные пользовательские интерфейсы для определения переноса материалов в разбавленных и концентрированных растворах или смесях при конвекции, диффузии и миграции ионов произвольного количества химических соединений. Все они легко связываются с определениями кинетики обратимых, необратимых и равновесных реакций, которые описываются уравнением Аррениуса или любым произвольным уравнением скорости реакции, при этом можно учитывать воздействие концентрации и температуры на кинетику. Интерфейс для определения химических реакций прост и понятен, поскольку химические формулы и уравнения вводятся фактически как при записи на бумаге. Используя закон действующих масс, COMSOL формирует подходящие схемы реакций, которые можно изменять или отклонять. Стехиометрия в формулах реакции используется для автоматического определения материального и энергетического балансов для условий гомогенного или гетерогенного реактора, в объеме или на поверхностях.
Дополнительные изображения с примерами:




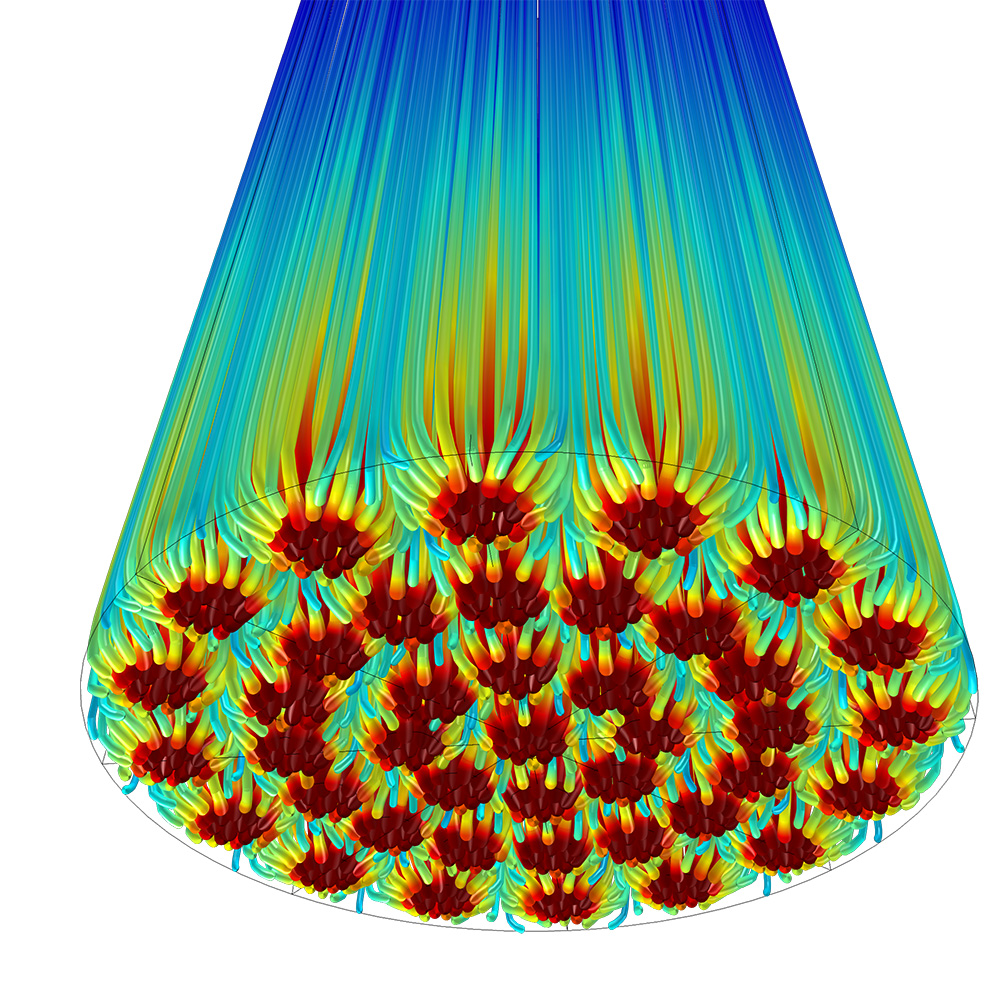
Явления полного переноса
Инструменты для расчета термодинамических свойств, в том числе из внешних источников, включены в модуль Chemical Reaction Engineering (Разработка химических реакций), чтобы добавить связь переноса тепла с балансами энтальпий к переносу масс и химическим реакциям. Также имеются пользовательские интерфейсы для определения переноса импульса, что позволяет учитывать вся явления переноса, присутствующие в вашем процессе. В частности, учитывается ламинарный поток и поток в пористой среде, описываемые уравнением Навье – Стокса, законом Дарси и уравнениями Бринкмана. Используя в модели модуль CFD (Вычислительная гидродинамика) или модуль Heat Transfer (Теплопередача) можно учитывать турбулентный поток, многофазный поток и неизотермальный поток, а также радиационную теплопередачу.
Неотъемлемая часть оптимизации процессов ваших химических реакций
Модуль Chemical Reaction Engineering (Разработка химических реакций) предназначен для инженеров и ученых, работающих, например, в химической, обрабатывающей, электроэнергетической, фармацевтической и пищевой отраслях или в производстве полимеров, где перенос материалов и химические реакции являются неотъемлемой частью технологического процесса. В модуле содержится инструментарий для всех аспектов применения: от «пробирочных» исследований в лаборатории до капитального ремонта химического реактора на заводе. Химическую кинетику можно моделировать в контролируемых средах для подробного их описания с использованием встроенных возможностей для оценки параметров и сравнения с экспериментальными данными. При этом в модуле Chemical Reaction Engineering (Разработка химических реакций) имеется ряд предварительно настроенных типов реакторов для более глубоких исследований:
- Реакторы периодического и полупериодического действия* Проточные реакторы с непрерывным перемешиванием* Реакторы идеального вытеснения
Эти типы реакторов предоставляются с необходимыми определениями постоянных или меняющихся масс и объемов, а также изотермических, неизотермических и адиабатических условий. Данные простые модели являются идеальным решением для внедрения оптимизированной кинетики в технологическую среду, они позволяют лучше понять систему и моделировать множество различных рабочих условий. Получив все эти знания, на следующем шаге можно оптимизировать конструкцию установки и рабочие условия, используя полную двухмерную осесимметричную или трехмерную модель. Функцию Generate Space-Dependent Model (Создание модели, зависящей от пространственных координат) можно использовать для всестороннего учета баланса масс и энергий системы с учетом скорости потока среды и протекания химических реакций.
Модуль Химические реакции
Ключевые особенности
- Модели автоматических идеальных реакторов с выдачей кинетических уравнений на основе химических формул
- Перенос массы в разбавленных и концентрированных смесях
- Перенос массы диффузией, конвекцией и ионной миграцией
- Многокомпонентный перенос масс
- Уравнения Фикиана, Нернста - Планка, Максвелла - Стефана, а также перенос, усредненный по смеси
- Учет микрокомпонентной диффузии для эффекта Соре
- Диффузия в тонких слоях
- Диффузионные барьеры
- Перенос веществ и теплопередача в пористых средах
- Модели корректирования пористости для параметров переноса масс
- Ламинарный поток и поток в пористой среде
- Формула Хагена - Пуазейля
- Уравнения Навье - Стокса, Бринкмана и закон Дарси
- Реакционный поток
- Поверхностная диффузия и реакции
- Адсорбция, абсорбция и отложение веществ на поверхностях
- Многоуровневый перенос и характеристики реакций
- Неограниченное количество химических веществ в произвольных определениях кинетики химических реакций в изотермических и неизотермических средах
- Модель Аррениуса
- Изотермы адсорбции, абсорбция и отложение веществ на поверхностях
- Реакционный поток в свободной и пористой среде
- Функция CHEMKIN® для импорта кинетических данных, термодинамических и транспортных свойств
- Поддержка термодинамических баз данных в формате CAPE-OPEN
Область применения
- Реакторы циклического действия, с пульсирующим потоком и корпусные
- Проектирование, выбор размеров и оптимизация реакторов
- Микрокомпонентный и мембранный перенос
- Реакторы со слоем насадки
- Адсорбция, абсорбция и отложение на поверхностях
- Биохимия и пищевые технологии
- Фармацевтический синтез
- Производство пластмасс и полимеро
- Электрохимическая технология
- Хроматография
- Осмос, электрофорез и электроосмос
- Фильтрация и осаждение
- Обработка выхлопных газов и снижение уровня вредных выбросов
- Устройства для ферментации и кристаллизации
- Циклоны, сепараторы, скрубберы и выщелачивающие агрегаты
- Предварительные камеры сгорания и двигатели внутреннего сгорания
- Монолитные реакторы и каталитические преобразователи
- Селективное каталитическое восстановление и катализаторы для него
- Водородные реформеры
- Обработка полупроводников и химическое осаждение из паровой фазы
- Микрогидравлические устройства и устройства типа «лаборатория на чипе»
Material Databases
1 Any file format is allowed, these are the most common extensions
2 Requires the Plasma Module
3 Any extension is allowed; These are the most common extensions
Модуль Химические реакции
Stephen Mackintosh
Lifescan Scotland
UK
T. Schauer, I. Guler
Boston Scientific Corporation, MN, USA
Stephen Mackintosh Lifescan Scotland UK
Lifescan Scotland is a medical device company that designs and manufactures blood glucose monitoring kits for the global diabetes market. These involve the self-monitoring of blood glucose levels through specialized monitoring systems and test strips that comprise of a plastic substrate, two carbon-based electrodes, a thin dry reagent layer, and ...
T. Schauer, I. Guler Boston Scientific Corporation, MN, USA
Stent insertion through the coronary artery is a common procedure used to treat restricted blood flow to the heart caused by stenosis. Following the procedure, restenosis may occur due to excessive tissue growth around the stent. Researchers at Boston Scientific are using multiphysics simulation to better understand how drug-eluting stents ...
Модуль Химические реакции
Chemical vapor deposition (CVD) allows a thin film to be grown on a substrate through molecules and molecular fragments adsorbing and reacting on a surface. This example illustrates the modeling of such a CVD reactor where triethyl-gallium first decomposes, and the reaction products along with arsine (AsH3<{:/sub>} adsorb and react on a ...
One of the most common reactors in the chemical industry, for use in heterogeneous catalytic processes, is the packed bed reactor. This type of reactor is used both in synthesis as well as in effluent treatment and catalytic combustion. This model is set up to calculate the concentration distribution in the reactor gas that flows around the ...
The model simulates non-premixed turbulent combustion of syngas (synthesis gas) in a simple round-jet burner. Syngas is a gas mixture, primarily composed of hydrogen, carbon monoxide and carbon dioxide. The name syngas relates to its use in creating synthetic natural gas. In the model, syngas is fed from a pipe into an open region with a slow ...
Surface reactions with adsorption-reaction-desorption steps are common in for example photocatalysis and biosensors. A flow cell in a biosensor contains an array of micropillars for adsorption of for example antigens in aqueous solutions. A signal proportional to the surface coverage can be detected in a sensor, for example through ...
Dialysis is a widely used chemical species separation method. One such example is hemodialysis, which acts as artificial kidneys for people with renal failure. In dialysis, only specific components are allowed to diffuse through the membrane, based on differences in molecular size and solubility. The Membrane Dialysis app simulates a process for ...
High-performance liquid chromatography (HPLC) is a common method of separating, identifying, and quantifying each chemical compound in a mixture. HPLC is found in the pharmaceutical, biotech, and food industries. The Liquid Chromatography app simulates the separation of two species within a generic liquid chromatography column. Simulations can ...
In this tutorial, the heat and mass transport equations are coupled to laminar flow in order to model exothermic reactions in a parallel plate reactor. It exemplifies how you can use COMSOL Multiphysics to systematically set up and solve increasingly sophisticated models using predefined physics interfaces.
Modeling packed beds, monolithic reactors, and other catalytic heterogeneous reactors is substantially simplified with the Reacting Flow in Porous Media multiphysics interface. This defines the diffusion, convection, migration, and reaction of chemical species for porous media flow without having to set up separate interfaces and couple them. The ...
In fuel cell power generators, a steam reformer unit typically produces the hydrogen needed for the cell stack. This example illustrates the modeling of a steam reformer. The reformation chemistry occurs in a porous catalytic bed where energy is supplied through heating tubes to drive the endothermal reaction system. The reactor is enclosed in ...
Tubular reactors are often used in continuous large-scale production, for example in the petroleum industry. One key design parameter is the conversion, or the amount of reactant that reacts to form the desired product. In order to achieve high conversion, process engineers optimize the reactor design: its length, width and heating system. An ...
Б)Для первого расчета схемы А пользуюсь либо практическим опытом, либо известными зависимостями задают параметр потока 2’’, а для схемы Б с параметрами потока 4’’ и проводят первый расчет так как все исходные данные системы будут известны, полученные в результате расчетов значения потока 2, 4’ не будут совпадать с предварительно заданными значениями 2’’,4’’, рассчитывают погрешность, задают новое значение параметра 2’’,4’’ приближенное к расчетным,и проводят 2-й расчет, операция приближений повторяется до тех пор, пока значение суммарной погрешности не станет ниже требуемой точности расчета.
Скорость внутренней диффузии можно увеличить размер поры и сокращая длину, одноко при этом уменьшается общая поверхность катализатора, а следовательно число активных центров, а следовательно и его активность, в связи с этим для каждого процесса существует катализатор с оптимальным размером пор, с другой стороны внутредиффузионный контроль можно преодолеть уменьшая размер частиц катализатора, в данном случае усложняется процесс так как мелкодисперсный катализатор легко уносит потоком сырья в смежную аппаратуру, стадия абсорбции субстрата на активных центрах катализатора, абсорбция носит активированный характер, активный центр должен быть настроен на субстрат: слабая абсорбция не вызывает активации молекулы субстрата͵ а излишне сильная затрудняет десорбцию продуктов активного центра. Перестройка электронной плотности в абсорбированных молекулах субстрата с образованием продукта связанного с активным центром. Десорбция продукта с активным центром скорость 3-4-5 стадии увеличивают подъемом температуры. Диффузия продукта через пограничный слой в объём потока, для ускорения применяют перемешивания.
Любой катализатор характеризуется следующими параметрами:
1) Активность, то есть способность ускорять реакцию по сравнению с отсутствием катализатора – чем выше, тем лучше, активность зависит от 2-х факторов: А) от способности активных центров уменьшать энергию активации процессов. Б) от количества активных центров.
2) Объемная скорость отдачи сырья показывает какое количество сырья можно пропустить через единицу объёма катализатора при заданной единице превращения
4) Способность катализатора работать долгое время без потери активности А) каталитическая реакция Б) реакции катализатора приводящие к потере каталитической активности в результате этих реакций катализатор дезактивируется, дезактивация должна быть обратимой то есть активность восстанавливается после регенерации, обратимую дезактивацию вызывает кокс и тяжелые углеводороды блокирующие активные центры, а так же вещества электронодоноры такие как CO2, H2O, NH3, эти полярные вещества абсорбируются на активных центрах, блокируя доступ субстрата͵ после удаления этих веществ из сырья вещества дисорбируются с активных центров и свойства катализаторов восстанавливаются. Кокс выжигают с поверхности катализатора, для нормальной работы катализаторов приходится удалять яды из сырья. Необратимая дезактивация происходит если вещество взаимодействует с разрушением активного центра катализатор регенерировать невозможно, крайне важно заменить широко распространенные платиновые катализаторы боятся кислород- азот- и серосодержащие соединения. Что бы катализатор работал долгое время, нужно проводить гидроотчистку, после отчистки содержание S,N
5) Температура зажигания – минимальная температура при которой каталитический процесс протекает с приемлемой для промышленного применения скоростью. На практике обычно процесс начинают при температуре чуть выше температуры зажигания и по мере потери активности температуру постепенно поднимают до предельно-возможной, после достижения этой температуры катализатор ставят на регенерацию.
6) Стоимость катализатора
7) Механическая прочность гранул
8) Для катализаторов работающих в подвижном слое важной характеристикой является износостойкость.
9) Межрегенерационный пробег время в течение которого катализатор не требует регенерации
10) Селективность катализатора – способность избирательно ускорять одну из нескольких возможных в данных условиях реакции
11) Общий срок службы
Химическим реактором принято называть аппарат в котором протекают химические превращения сопровождаемым тепло и массопереносом.
Классификации реакторов: реакторы классифицируют по гидродинамической обстановке: А) реакторы полного смешения (РИС) Б) реакторы идеального вытеснения (РИВ)
По организации процесса во времени: А) реакторы непрерывного действия с постоянным подводом сырья Б) периодическое воздействия работающее циклически В) полунепрерывные (полу-периодические) реактор работает непрерывно, а загрузка сырья или вывод продукта реализуются периодически
По тепловому режиму: А) адиобатический реактор это без теплообмена с окружающей средой Б) изотермический режим В) политермический ржим Г) автотермический политропический режим.
По характеру изменения параметров во времени А) стационарный режим – параметры постоянного време в каждой точке аппарата Б) настационарный режим
По конструктивным признакам: А) ямкостные реакторы – реакторы с мешалками и без Б) колонные реакторы – колонны с тарелками, насадкой подвижным или неподвижным слоем твердого вещества В) реакторы типа ʼʼТеплообменникʼʼ Г) реакторы типа реакционная печь – шахтные, барабанные, полочные печи, печи кипящего слоя, и так далее. Для описания процессов протекающих в реакторах применяют математические модели модель строят по иерархическому принципу, по этому модель имеет многоуровневую структуру. С начала, строят модель на более низком уровне, затем строят модель более высокого уровня. Уровни модели:
1) Уровень молекулярный уровень учитывает взаимодействие на расстояниях порядка молекул выраженный законами химической кинетики и химического равновесия
2) Уровень малого объёма рассматривает элемент реакционного объёма на пример зерно катализатора, пузырек газа, элемент насадки, элементарный объём реактора, закономерности первого уровня дополняются тепло и газо-переноса
3) Уровень рабочей зоны аппаратов – статистическая савакупность элементов малого объёма аппарата: полный объём аппарата͵ слой катализатора, слой насадки, объём пены, уровень учитывает дефекты связанные с движением потока, перенос импульса.
4) Уровень аппарата учитывает взаимное расположение рабочих зон (несколько слоев катализатора, несколько тарелок и так далее), модель должна учитывать протекающий химический процесс явление тепло- и массопереноса в связи с этим модель 2-го уровня включает в себя уравнение материального баланса и уравнение теплового баланса.
Моделирование химических реакций - понятие и виды. Классификация и особенности категории "Моделирование химических реакций" 2017, 2018.
Введение
В
кратком изложении суть представленных
в настоящей работе проблем состоит
в следующем. Развитие химии тесно
связано с построением математических
моделей. Можно сказать, что это
одна из наиболее распространенных и
информационно емких форм количественного
представления данных эксперимента.
Одна формула или значение коэффициента
в ней может квалифицированно
представлять результаты многочисленных
экспериментов.
Цели
моделирования в химии бывают
различными, от построения эмпирических
зависимостей без ограничений на
параметры и до количественной проверки
теоретических положений, для которой
как форма модели, так и значения
ее параметров должны соответствовать
физико-химическому смыслу этих положений.
В
нашей работе ставятся следующие
задачи:
-
рассмотреть основы кинетики
химических реакций на примере
гомогенных
-
примеры моделирования кинетических
уравнений на примере гомогенных
реакций
-
рассмотреть численный метод
Эйлера
-
исследовать математическую модель
протекания гомогенных реакций
-
разобрать типы моделей сложных
реакций
1 История химической кинетики
Химическая
кинетика – наука о скоростях
химических реакций, о динамическом
поведении реакционной системы
на ее пути к химическому равновесию.
Эта область физической химии
тесно связана с учением о
механизмах химических реакций, поскольку
химическая кинетика – один из методов
изучения механизмов, а механизм реакции,
как теперь стало ясно, есть основа
построения адекватной кинетической модели.
Закончился
XX век – столетие триумфального
развития химической кинетики, включающего
как микроуровень элементарного
акта, так и макроуровень многостадийных
процессов, отличающихся феноменальной
сложностью механизмов. Основы химической
кинетики как науки были заложены
в начале века работами нобелевских
лауреатов Я.Вант-Гоффа (1901 г), С.Аррениуса
(1903 г), В.Оствальда (1909 г), а также М.Боденштейна.
Различные аспекты теории элементарного
акта были развиты Г.Эйрингом, М.Поляни,
В.Г.Левичем и Р.Р.Догонадзе, лауреатами
нобелевской премии К.Фукуи и Р.Хоффманом
(1981 г), Г.Таубе (1983 г), Р.Маркусом (1992 г) и
многими другими исследователями. Теория
цепных реакций создана работами М.Боденштейна,
Й.Христиансена и нобелевских лауреатов
Н.Н.Семенова и С.Н.Хиншельвуда (1956 г), их
учеников и последователей.
Нобелевскими
премиями были отмечены методы и результаты
исследований быстрых элементарных
реакций (М.Эйген, Дж.Портер, Р.Норриш, 1967
г), а также разработка методов исследования
динамики элементарных актов газофазных
реакций (Д.Хершбах, Я.Ли, Дж.Поляни, 1986
г).
Выдающиеся
результаты были получены в области
кинетики гомогенных и гетерогенных
каталитических реакций. Отметим лишь
теорию
кинетики
гетерогенных реакций на неоднородных
поверхностях (М.И.Темкин и С.З.Рогинский),
теорию кинетики стационарных реакций
Хориути-Темкина, открытие катализа комплексами
палладия окислительных превращений олефинов
(И.И.Моисеев, М.Н.Варгафтик, Я.К.Сыркин,
Ю.Смидт и др.) и создание И.И.Моисеевым
теории этих процессов на основе детальных
кинетических исследований (премия им.
А.П.Карпинского, 1999 г).
Двадцатое
столетие увенчалось замечательным
открытием новой области физической
химии элементарного акта, названной
"фемтохимия", и нобелевской премией
по химии 1999 г американскому ученому, египтянину
А.Зевейлу (A.Zewail) "за его исследования
переходных состояний методом фемтосекундной
(10–15 сек) лазерной спектроскопии".
Достигнут предел измерения скоростей
химических реакций. Появилась возможность
следить за процессами, протекающими за
время одного колебания атомов в химической
связи – 10 – 100 фс. Переходное состояние
ряда реакций фиксируется с разрешением
0.1 A по координате реакции с полным спектральным
портретом. Достигнут уровень разрешения
соседних энергетических состояний ~10–4
см–1.
Все
результаты изучения "неравновесной"
кинетики химических реакций на микроуровне
чрезвычайно важны для обоснования
базовых принципов химической кинетики,
но пока мало полезны для решения задач
макроуровня – исследования механизмов
сложных реакций в газах, растворах и на
поверхности твердого тела в условиях
максвелл-больцмановского распределения,
т.е. задач "равновесной" кинетики
химических реакций. Если задача выяснения
механизмов и построения кинетических
моделей сложных реакций для "равновесной"
кинетики газофазных радикально-цепных
реакций решается практически (вследствие
возможности построения максимальных
механизмов или реакционных сетей с известными
константами скорости элементарных стадий),
то для сложных многомаршрутных процессов
в растворах и на поверхности решение
этой задачи только начинается. Эта проблема
XXI века.
2 Кинетика гомогенных химических реакций
Скорость химической реакции
есть изменение числа молей
реагентов в результате химического
взаимодействия в единицу времени
в единице объема (для гомогенных
реакций) или на единице поверхности
(для гетерогенных процессов) :
где С-
концентрация, моль/м 3 ,
или
Одним
из основных законов химической кинетики,
определяющим количественные закономерности
скоростей элементарных реакций, является
закон действующих масс.
Согласно
кинетическому закону действующих
масс скорость элементарной реакции при
заданной температуре пропорциональна
произведению концентраций реагирующих
веществ в степени, показывающей число
вступающих во взаимодействие частиц
(стехиометрических коэффициентов):
где
- предэкспоненциальный множитель;
E - энергия активации,
;
Т –
температура, К; R - газовая постоянная,
.
Константы
скорости реакций различного порядка
имеют разную размерность. Константа
скорости реакций первого порядка
(мономолекулярных) имеет размерность
с
-1
, константа скорости второго порядка
(бимолекулярных) – л/(моль*с).
На
основании уравнений (4) и (5) можно
записать:
-
=
(6а)
Кинетические уравнения связывают скорость реакции с параметрами, от которых она зависит. Наиболее важными из этих параметров являются концентрация, температура, давление, активность катализатора.
Рассмотрим гомогенную реакцию,
Между скоростями реакции по отдельным компонентам (обозначим их W A , W B , W C , W D) и общей скоростью реакции W существует зависимость
Чтобы применить закон действующих масс для сложной химической реакции, необходимо представить ее в виде элементарных стадий и применить этот закон к каждой стадии отдельно.
3 Примеры моделирования кинетических уравнений гомогенных химических реакций
Таким образом, кинетические модели гомогенных химических реакций представляют системы обыкновенных дифференциальных уравнений материального баланса.В результате решения системы дифференциальных уравнений получим зависимости изменения концентраций химических реагентов во времени.
- 4 Численные
методы решения кинетических уравнений
Простейшим численным методом решения обыкновенных дифференциальных уравнений является метод Эйлера. В основе этого метода лежит аппроксимация производной при малых изменениях аргумента.
Основная формула метода Эйлера имеет следующий вид
, (11)
где у i+1 – значение искомой переменной на последующем шаге;
у i – значение искомой переменной на текущем шаге;
f i – правые части дифференциального уравнения;
h – шаг интегрирования.
Например, скорость химической реакции описывается уравнением
величину называют шагом интегрирования. Решая уравнение (14), получим общую формулу Эйлера
| , | (15) |
.
Задав начальные условия: при t=0, С=С 0 , величину шага интегрирования h, а также параметры уравнения, с помощью формулы (15) можно провести пошаговый расчёт и получить решение данного уравнения (рисунок 1).
Приведем пример интегрирования первого шага системы уравнений (13) по методу Эйлера:
С А1 (t 1)= С А0 (t 0) +h· (-k·C A);
С B1 (t 1)= С B0 (t 0) +h· (k·C A);
Результаты первого шага зависят от начальной концентрации реагирующих веществ (С А0 и С B0) и величины шага h.
Организуя циклические вычисления по уравнению (15), получим для кинетической модели изменение концентраций реагирующих веществ от времени.
Величина шага интегрирования выбирается исходя из достижения минимального времени счёта и наименьшей ошибки вычислений.
Рисунок 1. Графическая иллюстрация метода Эйлера
5 Исследование кинетики гомогенных химических реакций
Исследование
кинетических закономерностей протекания
химической реакции методом математического
моделирования заключается в
определении изменения концентраций
реагирующих веществ во времени
при заданной температуре.
Пусть
протекают химические реакции
k 1
k 2
A
®
B +2C
®
D.
На
основании закона действующих масс
запишем уравнения скоростей
химических реакций и составим кинетическую
модель:
| ; ; ; ; , |
k i - константа скорости i-й химической реакции первого порядка, с -1 ; (для реакций второго порядка размерность константы ; для реакций третьего порядка размерность константы). W i - скорость i-й химической реакции, моль/л ? с; t - время реакции, с.
Систему обыкновенных дифференциальных уравнений первого порядка можно решить с использованием численного метода Эйлера, алгоритм которого записывается по уравнению (15).
Блок-схема расчета кинетики гомогенной химической реакции методом Эйлера приведена на рисунке 2.
Результаты исследования на математической модели влияния температуры на степень превращения исходного реагента и на концентрацию веществ представлены на рисунках 3,4.
Полученные результаты позволяют сделать вывод об оптимальном времени проведения процесса с целью получения целевого продукта. Математическая модель также позволяет исследовать влияние состава сырья на выход продуктов реакции.
Необходимо учитывать, что скорость химической реакции зависит от температуры, поэтому, чтобы использовать кинетическую модель для исследования процесса при различных температурах, необходимо ввести зависимость константы скорости химической реакции от температуры по уравнению Аррениуса.
Рисунок
2. Блок - схема расчета кинетики гомогенной
химической
реакции
методом Эйлера
6
Типы моделей математического
описания сложных процессов
Существует
три типа математических моделей (математического
описания) сложных процессов. Стохастические
модели используют вероятностные представления
о процессах в объекте исследования.
Вычисляются функции распределения
вероятностей для переменных параметров
модели (концентрация, температура
в случае химических процессов). Эти
модели пока что редко используются
в химической кинетике, но они оказались
полезными для описания и моделирования
поведения больших систем (химических
комплексов, химических предприятий).
Статистические модели используют для
описания эксперимента на работающем
объекте исследования. Описывается
связь значений входящих в систему
и выходящих из системы переменных
без использования физико- химической
информации о происходящих в объекте
процессах (модель черного ящика). Математическим
описанием поведения системы
обычно являются уравнения в форме
полиномов. Для обеспечения статистической
независимости параметров модели используют
планирование эксперимента (например,
ортогональные планы эксперимента). Детерминированные
модели основаны на закономерностях физико-химических
процессов с определенной структурой
модели. Именно такими моделями являются
теоретически обоснованные кинетические
модели.
При
математическом моделировании каталитического
процесса существует определенная иерархия
математических моделей. Модели первого
уровня – кинетические модели процессов
на зерне твердого катализатора или
в элементарном объеме жидкой фазы
в гомогенной реакции, неосложненные
процессами переноса массы, тепла и
гидродинамическими факторами. Модели
второго уровня в гетерогенном катализе
рассматривают процессы в слое катализатора,
а модели третьего уровня в гомогенном
и гетерогенном катализе – это
модели реактора в целом, включая все
процессы переноса и структуру потоков.
Такие модели нужны для исследования новых
реакций, для оптимизации каталитических
процессов, расчетов промышленных реакторов
(как составные части математической модели
реактора), для создания систем автоматизированного
управления процессом.
7 О понятии “механизм реакций”
Итак, в основе построения КМ лежит механизм процесса, т.е. совокупность элементарных стадий, приводящая к превращению исходных реагентов в конечные продукты реакций, причем для одной и той же реакции (каталитической или некаталитической) существует некоторое конечное множество механизмов, определяемое существующим на сегодня объемом знаний и действующими в химии парадигмами.Например, для реакции нуклеофильного замещения в ароматическом ядре ArX (некаталитической, катализируемой комплексами металлов или индуцированной переносом электронов с ArX и на ArX) установлено 8 механизмов:
Предложено 13 одномаршрутных и 80 двухмаршрутных механизмов простой реакции гидрирования этилена на металлических катализаторах. Другими словами, для каждой реакционной системы (реагенты, катализатор) существует некоторое множество элементарных стадий – реакционная сеть (максимальный механизм), отдельные блоки которой реализуются в зависимости от природы катализатора, условий, заместителей в субстрате, степени окисления металла-катализатора.
В конце столетия наметилось объединение физико-химического и формально-кинетического подходов в изучении механизмов. Был сформулирован взгляд на механизм как на единство двух составляющих этого понятия – топологической (структурной) и химической составляющих, и на их равноправие – нельзя однозначно установить структуру механизма (взаимосвязь элементарных стадий) на основе только формально-кинетического описания, так называемую "схему механизма", а потом наполнить ее химическим содержанием. Нельзя в общем случае из кинетических экспериментов получить информацию, необходимую для корректной идентификации схемы механизма, не задав этот механизм и не поставив соответствующие задачи для формально-кинетического метода.
Все эти обстоятельства вызвали необходимость пересмотра традиционной стратегии построения КМ.
8 Альтернативные стратегии моделирования КМ
Традиционная процедура построения КМ включает следующие этапы:Главный недостаток этой процедуры (стратегии) – отсутствие алгоритмов однозначного выполнения всех этапов. Поскольку эксперимент может быть адекватно описан большим числом математических моделей (уравнений), исследователь должен иметь какую-либо гипотезу о схеме механизма (о структуре механизма) или о форме предполагаемых уравнений. При этом подбор возможных гипотез (иногда интуитивный) происходит уже после сделанного эксперимента. Нет алгоритма перехода от математической модели к физической модели (особенно для многомаршрутных реакций) (этап (б)). Переход к механизму реакции (этап (в)) также произволен и не формализован. На всех этапах этой стратегии присутствует естественное стремление получить хотя бы одно уравнение (и "схему механизма"), не противоречащее эксперименту, и, очень часто, ни о какой дискриминации набора гипотез не идет речи. Напротив, авторы такой схемы механизма начинают ставить эксперименты, чтобы доказать механизм, представляющийся автору наиболее разумным. Вместе с тем, уже давно установлено, что доказать какую-либо гипотезу нельзя. Можно доказательно отбросить неработающие гипотезы и показать согласие с экспериментом оставшихся гипотез – множества работающих гипотез. Целесообразность выдвижения набора гипотез и получение множества работающих гипотез была убедительно обоснована более 100 лет назад американским ученым-геологом Т.Чемберленом.
Таким образом, рациональная стратегия построения КМ является четкой методологически обоснованной гипотетико-дедуктивной логической схемой исследования, поддержанной возможностями компьютеров и эффективным программным обеспечением. Суть этой стратегии отражена в последовательности ее этапов:
Дискриминация
гипотез может включать дискриминацию
стадий, блоков стадий, отдельных механизмов,
узлов сопряжения в многомаршрутных
реакциях.
Вид
КМ (формы математического описания)
зависит от особенностей механизма
(линейный или нелинейный), условий
проведения процесса (стационарный, квазистационарный,
нестационарный), типа реактора (открытый,
закрытый) и ряда принятых допущений.
Линейным механизмом называют механизм,
элементарные стадии которого в прямом
и обратном направлениях линейны
по интермедиатам – только одно
промежуточное соединение находится
слева (или справа) от стрелки в
элементарной стадии. Если в стадии
участвует больше одного интермедиата
(в том числе и 2 молекулы одного
интермедиата), стадии нелинейны и
механизм нелинейный.
Самым
общим видом КМ являются системы
дифференциальных уравнений, алгебро-дифференциальных
или алгебраических уравнений
,
(16)
правая
часть которых всегда есть произведение
матрицы стехиометрических коэффициентов
для стадий механизма (транспонированной)
на вектор-столбец скоростей элементарных
стадий (). В случае линейных механизмов для
реакции в стационарных или квазистационарных
условиях правая часть уравнения (1) преобразуется
в дробно-рациональные уравнения скоростей
по реагентам (R
i
) или скоростей
по маршрутам (R
p
). Системы
алгебраических уравнений для нелинейных
механизмов в общем случае не решаются,
и уравнения типа (16) не приводятся к более
простому дробно-рациональному виду.
В
случае кинетики на неоднородных поверхностях
в стационарных условиях скорость может
описываться и степенным уравнением
типа (17) (уравнение М.И.Темкина для синтеза
аммиака):
(17)
Коэффициент
m
= 0.5 в случае железного катализатора,
k
+ /k
– = K
– константа
равновесия реакции
Под прямой задачей химической кинетики понимают задачу нахождения концентраций участвующих в реакции веществ в любой момент времени, исходя из известных начальных концентраций, схемы реакции и констант скоростей отдельных стадий. Обратная задача химической кинетики - восстановление поизвестной зависимости концентрации веществ от времени схемы реакции и констант скорости.
9.1 Классификация обратных задач
Формальная
кинетика гомогенных химических реакций
основана на двух основныхпостулатах.
Согласно (кинетическому) закону действия
масс скорость элементарной стадии пропорциональна
концентрации участвующих в ней реагентов.
Коэффициент
пропорциональности и называется константой
скорости. Согласно принципу независимого
протекания отдельных стадий скорость
реакции не зависитот протекания в данный
момент в системе других химических реакций.
Такимобразом, зная схему реакции, легко
записать систему обыкновенных дифференциальных
уравнений, отражающую изменение концентрации
всехучаствующих в реакции веществ во
времени:
d
c/dt
= f
(k, c)
(18)
где с -
вектор концентраций веществ, k - вектор
констант скоростей отдельных стадий,
вид функции f
определяется схемой
реакции.
Интегрируя
эту систему аналитически либо численно,
получаем:
с = F(k, c 0 ,
t
)
(19)
где с 0
- вектор начальных концентраций веществ.
Пользуясь
введенными выше обозначениями, можно
выделить несколько ступеней в решении
обратной задачи.
Нулевая
ступень - проверка адекватности.
На ней дается ответ на вопрос, соответствуют
ли экспериментально наблюдаемые кривые
c(t) рассчитанным с использованием текущей
модели f и констант k.
Первая
ступень - параметрическая идентификация.
На этой ступени
находится
набор констант k, наилучшим образом
описывающий экспериментальные кривые
c
(t
) в рамках данной модели f
.
Понятно, что успешное решение задачи
первой ступени возможно, только опираясь
на нулевую ступень.
Вторая
ступень - структурная идентификация.
Выбор модели f
, соответствующей действительно
происходящей химической реакции, который
делается на основе решения задачи первой
ступени с привлечением других сведений
о механизме данной реакции.
.
9.2
Проверка адекватности и параметрическая
идентификация
В
случае достаточно простой схемы
реакции, когда возможно получение
функции c
(t
) в явном виде, проверка
адекватности сводится к вычислению теоретических
значений функции при различных значениях
времени и сравнении их с экспериментальными.
К сожалению, часто системы дифференциальных
уравнений, описывающие сложные химические
реакции, не могут быть проинтегрированы
в аналитическом виде, и приходится прибегать
к численным методам интегрирования.
и т.д.................
Теоретическая часть
Цель работы
Ознакомиться с методами построения кинетических моделей гомогенных химических реакций.
Построить кинетическую модель заданной химической реакции.
Исследовать влияние температуры на выход продуктов и степень превращения.
кинетический химический реакция гомогенный
Кинетика гомогенных химических реакций
Скорость химической реакции есть изменение числа молей реагентов в результате химического взаимодействия в единицу времени в единице объема
Одним из основных законов химической кинетики, определяющим количественные закономерности скоростей элементарных реакций, является закон действующих масс.
Константа скорости химической реакции является функцией температуры, и зависимость её от температуры выражается законом Аррениуса:
Порядок выполнения работы
Составить в соответствии с заданной схемой реакций на основании закона действующих масс кинетическую модель.
Разработать алгоритм расчёта составленной кинетической модели с использованием численного метода Эйлера.
Разработать программу расчета кинетики с учетом температурной зависимости констант скорости гомогенной химической реакции.
Обсудить результаты. Сделать выводы по работе.
Практическая часть
Задание №11
А → В ↔ С
Сa0=0,8 моль/л; Cb0=Cc0=0моль/л;
h1=20; K10=0.3; K20=0.25; K30=0.18; E1=10; E2=8; E3=9; T1=393; T2=453; R=8.31;lb2;mas=array of real;tempk=10.0; h=1.0; Ca0=0.8; Cb0=0; Cc0=0; K10=0.3; K20=0.25; K30=0.18; E1=10; E2=8; E3=9; T1=393; T2=453; R=8.31; h1=20;C, f: mas; i:integer; T, k1, k2, k3, temp:real;:=T1;T<=T2 do begin:=k10*exp(-E1/(R*T));:=k20*exp(-E2/(R*T));:=k30*exp(-E3/(R*T));("T=", T:5:2, " ",
"k1=", k1:5:5, " ",
"k2=", k2:5:5, " ",
"k3=", k3:5:5, " ");:=0; C:=Ca0; C:=Cb0; C:=Cc0;temp<=tempk do begin:=-k1*C;:=K1*C-K2*C+K3*c;:=K2*C-K3*C;i:=1 to 3 do C[i]:=C[i]+h*f[i];("C=", C:5:2, " ",
"C=", C:5:2, " ",
"C=", C:5:2, " ",
"temp=", temp:5:2);:=temp+h; end;
T:=T+h1; end;.
Температура 393 К
k1=0,29908k2=0,24939k3=0,17950Концентрация С1ВремяКонцентрация С2ВремяКонцентрация С3Время0,5600,240000,3910,3510,0610,2820,3920,1420,1930,430,2130,1440,3940,2740,0950,3950,3250,0760,3760,3660,0570,3770,3970,0380,3680,4180,0290,3590,4390,02100,35100,4410
Температура 413 К
k1=0.29913 k2=0.24942 k3=0.17953Концентрация С1ВремяКонцентрация С2ВремяКонцентрация С3Время0.56 00.24 00.00 00.39 10.35 10.06 10.28 20.39 20.14 20.19 30.40 30.21 30.14 40.39 40.27 40.09 50.39 50.32 50.07 60.37 60.36 60.05 70.37 70.39 70.03 80.36 80.41 80.02 90.35 90.43 90.02 100.35 100.44 10
k1=0.29917 k2=0.24944 k3=0.17955 Концентрация С1ВремяКонцентрация С2ВремяКонцентрация С3Время0.56 00.24 00.00 00.39 10.35 10.06 10.28 20.39 20.14 20.19 30.40 30.21 30.14 40.39 40.27 40.09 50.39 50.32 50.07 60.37 60.36 60.05 70.37 70.39 70.03 80.36 80.44 80.02 90.35 90.43 90.02 100.35 100.41 10
Температура 453 К
k1=0.29920 k2=0.24947 k3=0.17957 Концентрация С1ВремяКонцентрация С2ВремяКонцентрация С3Время0.56 00.24 00.00 00.39 10.35 10.06 10.28 20.39 20.14 20.19 30.40 30.21 30.14 40.39 40.27 40.09 50.39 50.32 50.07 60.37 60.36 60.05 70.37 70.39 70.02 80.35 80.41 80.02 90.35 90.44 90.03 100.36 100.43 10
Вывод
В ходе лабораторной работы, составили кинетические модели гомогенной химической реакции; построили кинетическую модель химической гомогенной реакции; рассчитали концентрации реагирующего, промежуточных веществ и продукта реакции при различных температурах и времени протекания реакции. Построили зависимости изменения концентрации от времени, при увеличении времени протекания реакции концентрация исходного вещества уменьшается, промежуточных веществ увеличиваются, а концентрация продукта реакции - возрастает. Рекомендации по условиям проведения химической реакции с целью получения максимального выхода целевого продукта С: температура 393 К и время 10 с.
Этапы моделирования
Процесс как теоретического, так и экспериментального моделирования состоит из следующих шагов:
1. Построение модели.
2. Изучение модели.
3. Экстраполяция - перенос полученных данных на область знаний об исходном объекте.
На первом этапе, при осознании невозможности или нецелесообразности прямого изучения объекта, создается его модель. Целью этого этапа является создание условий для полноценного замещения оригинала объектом-посредником, воспроизводящим его необходимые параметры.
На втором этапе производится изучение самой модели - настолько детальное, насколько это требуется для решения конкретной познавательной задачи. Здесь исследователь может вести наблюдения за поведением модели, проводить над ней эксперименты, измерять или описывать ее характеристики - в зависимости от специфики самой модели и от исходной познавательной задачи. Цель второго этапа - получение требуемой информации о модели.
Третий этап (экстраполяционный) представляет собой «возвращение» к исходному объекту, т.е. интерпретацию полученных знаний о модели, оценку их приемлемости и, соответственно, приложение их к оригиналу, позволяющее в случае успеха решить исходную познавательную задачу.
Эти шаги реализуют своеобразный цикл моделирования, в ходе которого модель и оригинал соотносятся друг с другом (рис.1).
Рис. 1. Этапы моделирования
Моделирование в химии
Моделирование молекул, химических процессов и реакций
Материальное (экспериментальное) моделирование широко используется в химии для познания и изучения строения веществ и особенностей протекания химических реакций, для выявления оптимальных условий химико-технологических процессов и др.
В биохимии и фармакологии моделирование играет очень большую роль. Прогресс фармакологии характеризуется непрерывным поиском и созданием новых, более совершенных препаратов. В последние годы при создании новых препаратов за основу берется не биологически активное вещество, как это делалось ранее, а субстрат, с которым оно взаимодействует (рецептор, фермент и т.п.). Для таких исследований необходимы максимально подробные данные о трехмерной структуре тех макромолекул, которые являются основной мишенью для препарата. В настоящее время имеется банк таких данных, включающих значительное число ферментов и нуклеиновых кислот. Прогрессу в этом направлении способствовал ряд факторов. Прежде всего, был усовершенствован рентгеноструктурный анализ, а также разработана спектроскопия, основанная на ядерно-магнитном резонансе. Последний метод открыл принципиально новые возможности, так как он позволил устанавливать трехмерную структуру веществ в растворе, т.е. в некристаллическом состоянии. Существенным моментом явилось и то, что с помощью генной инженерии удалось получить достаточное количество субстратов для подробного химического и физико-химического исследования.
Используя имеющиеся данные о свойствах многих макромолекул, удается с помощью компьютеров моделировать их структуру. Это дает четкое представление о геометрии не только всей молекулы, но и ее активных центров, взаимодействующих с лигандами. Исследуются особенности топографии поверхности субстрата, характер его структурных элементов и возможные виды межатомного взаимодействия с эндогенными веществами или ксенобиотиками. С другой стороны, компьютерное моделирование молекул, использование графических систем и соответствующих статистических методов, позволяет составить достаточно полное представление о трехмерной структуре фармакологических веществ и распределении их электронных полей. Такая суммарная информация о физиологически активных веществах и субстрате должна способствовать эффективному конструированию потенциальных лигандов с высокими комплиментарностью и аффинитетом. До сих пор о таких возможностях можно было только мечтать -- сейчас они становятся реальностью.
Компьютерное моделирование молекул основывается на многочисленных приближениях и допущениях. Так, предполагается, что энергия молекул определяется только координатами их атомов в пространстве. Но в реальности молекулы не являются неподвижными, а энергетические расчёты на компьютере проводятся на статических молекулах. Сейчас разрабатываются методы молекулярной динамики, которые позволяют учитывать тепловое движение молекул, но до сих пор нет подходов, которые бы достоверно учитывали энтропийную составляющую энергии. К тому же в разумные сроки можно рассчитать время жизни системы порядка нескольких пикосекунд.
Большие сложности представляет изучение трёхмерной структуры белков. На сегодняшний день нет методов, которые могли бы точно предсказать трёхмерную структуру белка на основе его аминокислотной последовательности. Хотя используется метод аналогий, когда предполагается, что идентичные аминокислотные участки разных белков укладываются аналогичным образом. Экспериментальное же получение трёхмерных изображений сопряжено с множеством трудностей: для проведения рентгеноструктурного анализа требуется кристаллизация белка (что возможно только для растворимых белков), а возможности ядерного магнитного резонанса ограничиваются молекулярным размером белков.
Роль молекулярного моделирования, как для фундаментальных, так и для прикладных исследований в области молекулярной биологии и биохимии неуклонно растёт. Это связано и с совершенствованием математического аппарата, и с ростом производительности вычислительной техники, и накоплением огромного количества фактического материала, требующего анализа.
Моделирование химических реакторов применяется для предсказания результатов протекания химико-технологических процессов при заданных условиях в аппаратах любого размера. Попытки осуществить масштабный переход от реактора малого размера к промышленному реактору при помощи физического моделирования оказались безуспешными из-за несовместимости условий подобия химических и физических составляющих процесса (влияние физических факторов на скорость химического превращения в реакторах разного размера существенно различно). Поэтому для масштабного перехода преимущественно использовались эмпирические методы: процессы исследовались в последовательно увеличивающихся реакторах (лабораторная, укрупнённая, опытная, полупромышленная установки, промышленный реактор).
Исследовать реактор в целом и осуществить масштабный переход позволило математическое моделирование. Процесс в реакторе складывается из большого числа химических и физических взаимодействий на различных структурных уровнях -- молекула, макрообласть, элемент реактора, реактор. В соответствии со структурными уровнями процесса строится многоступенчатая математическая модель реактора. Первому уровню (собственно химическому превращению) соответствует кинетическая модель, уравнения которой описывают зависимость скорости реакции от концентрации реагирующих веществ, температуры и давления во всей области их изменений, охватывающей практические условия проведения процесса. Характер следующих структурных уровней зависит от типа реактора. Например, для реактора с неподвижным слоем катализатора второй уровень -- процесс, протекающий на одном зерне катализатора, когда существенны перенос вещества и перенос тепла в пористом зерне. Каждый последующий структурный уровень включает все предыдущие как составные части, например математическое описание процесса на одном зерне катализатора включает как уравнения переноса, так и кинетические. Модель третьего уровня включает, кроме того, уравнения переноса вещества, тепла и импульса в слое катализатора и т. д. Модели реакторов других типов (с псевдосжиженным слоем, колонного типа с суспендированным катализатором и др.) также имеют иерархическую структуру.
С помощью математического моделирования выбираются оптимальные условия проведения процесса, определяются необходимое количество катализатора, размеры и форма реактора, параметрическая чувствительность процесса к начальным и краевым условиям, переходные режимы, а также исследуется устойчивость процесса. В ряде случаев сначала проводится теоретическая оптимизация -- определяются оптимальные условия, при которых выход полезного продукта наибольший, независимо от того, смогут ли они быть осуществлены, а затем, на втором этапе, выбирается инженерное решение, позволяющее наилучшим образом приблизиться к теоретическому оптимальному режиму с учётом экономических и других показателей. Для осуществления найденных режимов и нормальной работы реактора необходимо обеспечить равномерное распределение реакционной смеси по сечению реактора и полноту смешения потоков, различающихся составом и температурой. Эти задачи решаются физическим (аэрогидродинамическим) моделированием выбранной конструкции реактора.
Для исследования различных процессов, в которых протекают фазовые и химические превращения, применяются методы термодинамического моделирования .
Термодинамическое моделирование фазово-химических превращений основывается, с одной стороны, на законах и методах химической термодинамики, с другой - на математическом аппарате решения экстремальных задач. Полноценное сочетание этих двух подходов позволяет реализовать методику расчета, которая не имеет принципиальных ограничений на природу и компонентность исследуемых систем.
Для исследования различных практических и теоретических задач, связанных с фазовыми и химическими превращениями, необходимо глубокое и детальное исследование физико-химической сущности процесса, выявление закономерностей протекающих при этом фазовых и химических превращений, влияния на них и на выход продукта параметров состояния (температуры, давления, состава реакционной смеси и др.).
Сложность большинства реальных физико-химических процессов не позволяет решить описанные проблемы исключительно экспериментальным путем. Анализ возможных подходов показывает эффективность привлечения современных теорий и методов физико-химического и математического моделирования и расчета с использованием термодинамических представлений. C помощью данных методов можно проводить детальное исследование фазовых и химических превращений.
Теоретическое моделирование
Роль теоретического моделирования в развитии химической науки особенно значима, так как мир атомов и молекул скрыт от непосредственного наблюдения исследователя. Поэтому познание осуществляется путем построения моделей невидимых объектов по косвенным данным.
Рис. 2. Построение и изменение моделей
Процесс теоретического моделирования, как уже было сказано выше, осуществляется поэтапно: построение модели, изучение модели и экстраполяция. На каждом этапе можно выделить определенные действия, необходимые для его осуществления (рис 2). Модели могут дополняться, изменяться и даже заменяться новыми моделями. Такие процессы происходят, если исследователи сталкиваются с новыми фактами, противоречащими построенной модели. Новая модель - результат переосмысления противоречий старой модели и вновь полученных данных.
Рассмотрим специфику процесса познания при теоретическом моделировании.
Идеальное моделирование является одним из методов теоретического познания. Таким образом, такие структурные компоненты теоретического знания, как проблема, гипотеза и теория, должны составлять основу теоретического моделирования.
После накопления фактологического материала и его анализа выявляется и формулируется проблема. Проблема - форма теоретического знания, содержанием которой является то, что еще не познано человеком, но что нужно познать. Иначе говоря, это знание о незнании, вопрос, возникший в ходе познания и требующий ответа. Проблема не есть застывшая форма знания, а процесс, включающий два основных момента (этапа движения познания) - ее постановку и решение. Правильное выведение проблемного знания из предшествующих фактов и обобщений, умение верно поставить проблему - необходимая предпосылка ее успешного решения. "Формулировка проблемы часто более существенна, чем ее разрешение, которое может быть делом лишь математического или экспериментального искусства. Постановка новых вопросов, развитие новых возможностей, рассмотрение старых проблем под новым углом зрения требуют творческого воображения и отражают действительный успех в науке" .
В. Гейзенберг отмечал, что при постановке и решении научных проблем необходимо следующее: а) определенная система понятий, с помощью которых исследователь будет фиксировать те или иные феномены; б) система методов, избираемая с учетом целей исследования и характера решаемых проблем; в) опора на научные традиции, поскольку, по мнению Гейзенберга, "в деле выбора проблемы традиция, ход исторического развития играют существенную роль", хотя, конечно, определенное значение имеют интересы и наклонности самого ученого.
Как считает К. Поппер, наука начинает не с наблюдений, а именно с проблем, и ее развитие есть переход от одних проблем к другим - от менее глубоких к более глубоким. Проблемы возникают, по его мнению, либо как следствие противоречия в отдельной теории, либо при столкновении двух различных теорий, либо в результате столкновения теории с наблюдениями.
Тем самым научная проблема выражается в наличии противоречивой ситуации (выступающей в виде противоположных позиций), которая требует соответствующего разрешения. Определяющее влияние на способ постановки и решения проблемы имеют, во-первых, характер мышления той эпохи, в которую формулируется проблема, и, во-вторых, уровень знания о тех объектах, которых касается возникшая проблема. Каждой исторической эпохе свойственны свои характерные формы проблемных ситуаций.
Для решения выявленной проблемы ученым формулируется гипотеза. Гипотеза - форма теоретического знания, содержащая предположение, сформулированное на основе ряда фактов, истинное значение которого неопределенно и нуждается в доказательстве. Гипотетическое знание носит вероятный, а не достоверный характер и требует проверки, обоснования. В ходе доказательства выдвинутых гипотез одни из них становятся истинной теорией, другие видоизменяются, уточняются и конкретизируются, третьи отбрасываются, превращаются в заблуждения, если проверка дает отрицательный результат. Выдвижение новой гипотезы, как правило, опирается на результаты проверки старой, даже в том случае, если эти результаты были отрицательными.
Так, например, выдвинутая Планком квантовая гипотеза после проверки стала научной теорией, а гипотезы о существовании "теплорода", "флогистона", "эфира" и др., не найдя подтверждения, были опровергнуты, перешли в заблуждения. Стадию гипотезы прошел и открытый Д.И. Менделеевым периодический закон.
Д.И. Менделеев считал, что в организации целеустремленного, планомерного изучения явлений ничто не может заменить построения гипотез. "Они, - писал великий русский химик, - науке и особенно ее изучению необходимы. Они дают стройность и простоту, каких без их допущения достичь трудно. Вся история наук это показывает. А потому можно смело сказать: лучше держаться такой гипотезы, которая может со временем стать верною, чем никакой".
Согласно Менделееву, гипотеза является необходимым элементом естественнонаучного познания, которое обязательно включает в себя: а) собирание, описание, систематизацию и изучение фактов; б) составление гипотезы или предположения о причинной связи явлений; в) опытную проверку логических следствий из гипотез; г) превращение гипотез в достоверные теории или отбрасывание ранее принятой гипотезы и выдвижение новой. Д.И. Менделеев ясно понимал, что без гипотезы не может быть достоверной теории: "Наблюдая, изображая и описывая видимое и подлежащее прямому наблюдению - при помощи органов чувств, мы можем при изучении надеяться, что сперва явятся гипотезы, а потом и теории того, что ныне приходится положить в основу изучаемого".
Таким образом, гипотеза может существовать лишь до тех пор, пока не противоречит достоверным фактам опыта, в противном случае она становится просто фикцией. Она проверяется (верифицируется) соответствующими опытными фактами (в особенности экспериментом), получая характер истины. Гипотеза является плодотворной, если может привести к новым знаниям и новым методам познания, к объяснению широкого круга явлений.
Гипотеза как метод развития научно-теоретического знания в своем применении проходит следующие основные этапы.
1. Попытка объяснить изучаемое явление на основе известных фактов и уже имеющихся в науке законов и теорий. Если такая попытка не удается, то делается дальнейший шаг.
2. Выдвижение догадки, предположения о причинах и закономерностях данного явления, его свойств, связей и отношений, о его возникновении и развитии и т.п. На этом этапе познания выдвинутое положение представляет собой вероятное знание, еще не доказанное логически и не настолько подтвержденное опытом, чтобы считаться достоверным. Чаще всего выдвигается несколько предположений для объяснения одного и того же явления.
3. Оценка основательности, эффективности выдвинутых предположений и отбор из их множества наиболее вероятного на основе указанных свыше условий обоснованности гипотезы.
4. Развертывание выдвинутого предположения в целостную систему знания и дедуктивное выведение из него следствий с целью их последующей эмпирической проверки.
5. Опытная, экспериментальная проверка выдвинутых из гипотезы следствий. В результате этой проверки гипотеза либо "переходит в ранг" научной теории, или опровергается, "сходит с научной сцены". Однако следует иметь в виду, что эмпирическое подтверждение следствий из гипотезы не гарантирует в полной мере ее истинности, а опровержение одного из следствий не свидетельствует однозначно о ее ложности в целом. Эта ситуация особенно характерна для научных революций, когда происходит коренная ломка фундаментальных концепций и методов и возникают принципиально новые идеи.
Таким образом, решающей проверкой истинности гипотезы является в конечном счете практика во всех своих формах, но определенную (вспомогательную) роль в доказательстве или опровержении гипотетического знания играет и логический (теоретический) критерий истины. Проверенная и доказанная гипотеза переходит в разряд достоверных истин, становится научной теорией.
Новые статьи
- Как правильно лечить молочницу
- Молитва Ефрема Сирина в великий пост: когда читается дома
- Салат с кальмарами — самые вкусные рецепты
- Салат с корейской морковью — пикантность и очарование вкуса
- Рождество Пресвятой Богородицы: история, традиции и приметы праздника С днем девы марии
- Как приготовить холодец в домашних условиях
- Рецепты приготовления свиных почек с фото Как приготовить почки чтобы не было запаха
- Как приготовить ленивые голубцы
- Быстрый рецепт приготовления маринованных огурцов в пакете: малосольные и вкусные
- Рецепт быстрого приготовления малосольных огурцов в пакете
Популярные статьи
- Приготовление холодца в домашних
- Сонник разговаривать по телефону с мужчиной
- Техподдержка ВКонтакте: телефон горячей линии
- Устала от моих командировок
- Правильное составление заявления на развод, если нет детей (бесплатные образцы) Что нужно для развода если нет детей
- Что означает тату корона?
- Суффиксы отрицания в английском
- Постоянное ощущение, что хочется в туалет по маленькому
- Сонник толкование трава зеленая
- «Валенки к чему снятся во сне?
